光动力治疗(PDT)因其微创性、高时空选择性和低全身毒性,已成为临床获批用于肿瘤治疗的重要手段。PDT依赖光敏剂在光照下产生活性氧(ROS)以杀伤肿瘤细胞,然而氧化应激常触发细胞内还原性物种,尤其是谷胱甘肽(GSH)的补偿性上调。高浓度的GSH能够缓解氧化损伤,从而削弱PDT的治疗效果。因此,若能在产生活性氧的同时氧化细胞内GSH,将可能放大氧化损伤,显著提升PDT疗效。但目前,对GSH进行可控且高效的氧化仍是一大挑战。
理论上,I-型光动力过程具备同时产生ROS与氧化胞内还原物种的潜力。与通过激发态能量传递产生单线态氧(¹O₂)的II-型机制不同,I-型光动力机制可通过光诱导电子转移过程从生物底物分子中抽取电子,并将其转移给组织氧生成超氧阴离子自由基 (O₂⁻•) 等活性氧自由基物种,因此,I-型光敏剂具有同时氧化生物分子和产生活性氧的潜力。基于此,杨清正团队近年来开发了系列可同时氧化生物分子并产生ROS的I-型光敏剂体系 (Angew. Chem. Int. Ed. 2024, 63, e202318783; J. Am. Chem. Soc. 2023, 145, 4081; Nat. Commun. 2022, 13, 6179),然而,由于光敏剂与GSH之间的电位匹配困难以及电子转移效率不足,目前的光敏剂难以直接氧化GSH。团队近期开发的基于氢原子转移(HAT)介导的光氧化机制为解决上述局限提供了新思路 (Angew. Chem. Int. Ed. 2025, 64, e202413595),区别于依赖氧化还原电位匹配的电子转移机制,HAT过程以键解离能(BDE)为核心选择准则,不受氧化还原电位的限制。鉴于GSH 中的 S-H 键的键能较低(约 87 kcal·mol⁻¹),推测通过光诱导的 HAT 途径有望实现对 GSH 的高效氧化。
基于此理念,杨清正团队报道了一种基于氢原子转移I-型超分子光敏剂,该光敏剂可在光照下直接氧化GSH的同时生成O₂⁻•。设计将经典的 HAT 催化剂 N-羟基邻苯二甲酰亚胺(NHPI)共价连接到 β-环糊精得到CD-NHPI作为HAT催化单元和主体分子,选用 BODIPY 型光敏剂(BDP)作为光敏客体分子。通过超分子主客体作用可以拉近分子间距离,在光照下,CD-NHPI向BDP发生光诱导电子转移,形成BDP⁻•和CD-NHPI+•。其中,BDP⁻• 还原氧气生成 O₂⁻•,而CD-NHPI+• 通过脱质子生成氧自由基中间体,该中间体可从 GSH 攫取氢原子并将其氧化,最终实现了GSH的直接消耗与ROS的同时生成。
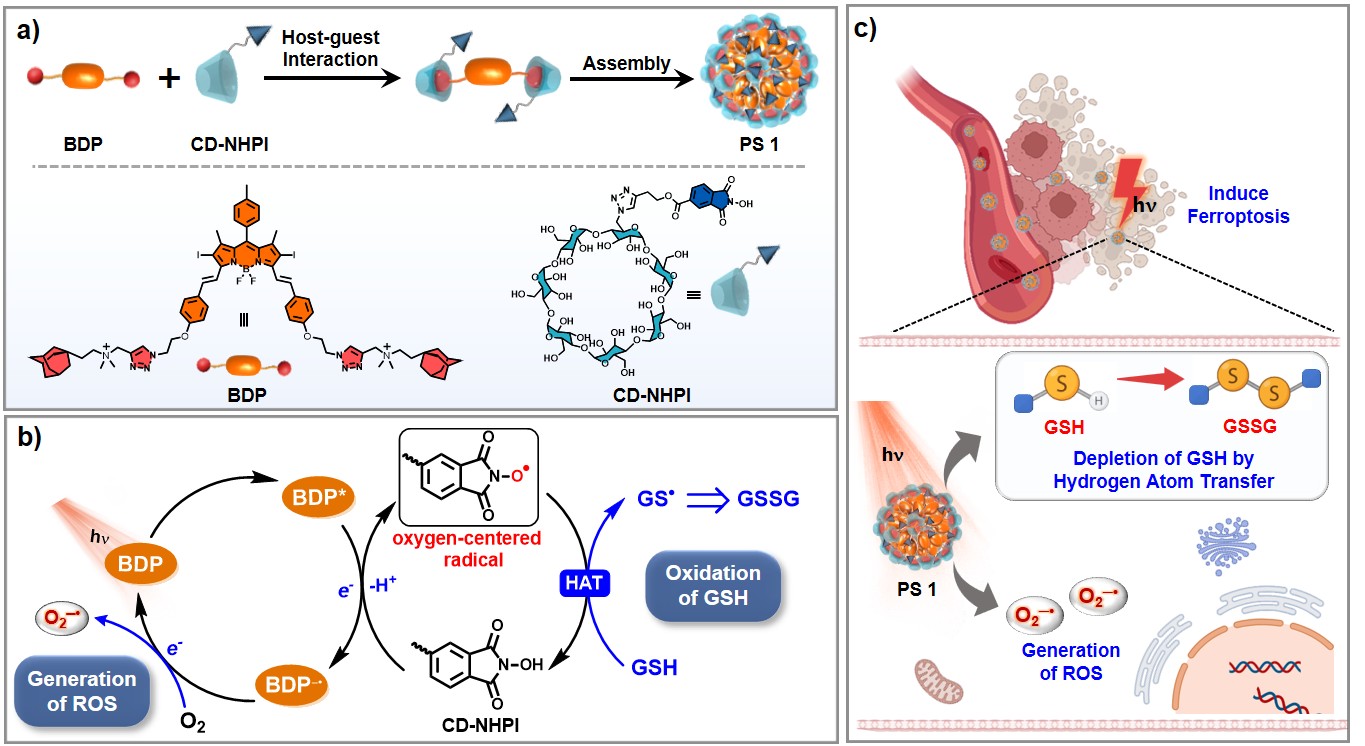
该工作系统研究了光敏剂的电子/氢原子转移机制、氧自由基的产生、活性氧生成情况以及对GSH的氧化效率等,进一步的体外细胞实验显示,该光敏剂在光照条件下能够有效诱导肿瘤细胞铁死亡,体内小鼠肿瘤模型实验进一步证明其具有优异的抗肿瘤活性。通过 HAT 机制直接氧化生物底物的分子设计策略,为开发新型 I-型光敏剂提供了新思路。
研究成果已发表于 J. Am. Chem. Soc. 2025, doi: 10.1021/jacs.5c14257,文章第一作者为色情直播
硕士研究生林一,通讯作者为滕坤旭博士与杨清正教授。该团队近期亦在Angew. Chem. Int. Ed. 2025, 64, e202509416发表综述 “Rational Design of Type-I Photodynamic Agents”,系统总结了I-型光动力治疗的机制、优势及I-型光敏剂的理性分子设计策略。
感谢国家自然科学基金委、博士后基金和色情直播
对该研究工作的经费支持。